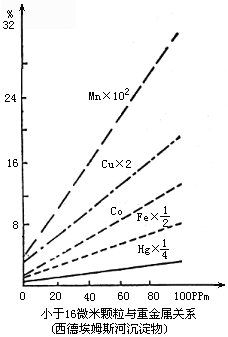
2)吸附作用 天然水体中的底泥和悬浮物含有丰富的胶体(各种粘土矿物如蒙脱石、高岭石、伊利石、各种水合金属氧化物、各种溶性与不溶性的腐殖质等)。胶体由于有巨大的比表面和带大量电荷,能强烈地吸附重金属离子。胶体的吸附作用是使许多微最重金属从不饱和的天然水溶液中由液相转入固相的最主要途径。胶体的吸附作用在很大程度上控制着重金属在环境中的分布与富集状况,水体底泥中重金属的含量往往与其中粘粒的含量成正比,如西德埃姆斯河流沉积物中Mn、Co、Cu、Fe、Hg的含量与小于16微米的粘粒成正比(图7-5),吸附作用和沉淀作用一样,大大限制了金属污染物在水体中的扩散范围,使金属污染物主要富集于排水口附近的底泥中。另外使重金属在河流中的迁移主要是以吸附于悬浮物上被流水搬运。
3)络合与螯合作用 水体中存在着多种多样的天然与人工合成的无机与有机配位体,它们能与重金属形成稳定的络合物和螯合物,对重金属在水体中的迁移有很大影响。天然水中最常见的无机配位体是Cl-、SO42-、HCO3-、OH-等,在某些情况下还有F-、S2-和磷酸盐等。它们均能与重金属形成络离子。
对某些重金属来说,很少见到它们在水中以简单离子形式存在,而主要以各种络离子形式存在,如在富氧的淡水中汞主要以Hg(OH)20、HgCl20形式存在;在海水中主要以HgCl3-、HgCl42-形式存在。无机配位体OH-、Cl-等对重金属的络合作用可以大大提高某些重金属化合物的溶解度。如根据相应的氢氧化物溶度积计算,水中只可能存在0.86ppm的Zn2 和0.039ppmHg2 ,然而当生成Zn(OH)20与Hg(OH)20时水中总溶解锌可达160ppm、总溶解汞可达107ppm;又如当水中Cl-的浓度为1克分子时,可使氢氧化汞和硫化汞浓度分别增加105 倍和107倍。

水中的有机配位体最主要的是腐殖质,腐殖质能起螯合作用基团的是分子侧链上的各种含氧官能团:—COOH、—OH、可能还有—C=O和 NH等,几乎所有的金属离子都与腐殖质生成螯合物。水体中的重金属与腐殖质生成可溶性螯合物能有效地阻止重金属作为难溶盐而沉淀。总之,各种无机与有机配位体与重金属生成的螯合物可使重金属在水中溶解度增大,使已进入底泥的重金属有可能重新释放出来,重金属的次生污染问题在相当程度上与此有关。
4)氧化还原作用 不少重金属元素化学价态变化广泛,能在较宽的幅度内发生电子得失的氧化还原反应。各价态变化反应要求不同的氧化还原条件,而在水体中有富氧的氧化性区域和缺氧的还原性区域,这样就使得在不同条件下的水体中以不同的价态存在。重金属的价态不同,其活性与毒性效应也不同。以铬为例,铬在水体中主要有二种价态:正三价(Cr3 )和正六价(Cr2 O42-)。从毒性上看六价铬远大于三价铬,所以过去制定饮水卫生标准时均以六价铬为依据,但近年来研究证明,在正常pH值的天然水中三价铬与六价铬可以相互转化,天然水中的六价铬可被二价铁离子、溶解性硫化物和某些带硫基的有机化合物还原,天然水中的三价铬可被MnO2氧化,也可被水中溶解氧低速氧化。鉴于此种情况,美国一些学者建议铬的水质标准应该根据总铬制定(不能象过去一样仅根据六价铬来制定)。
4.重金属污染水体的危害
从毒性及对生物与人体的危害方面看,重金属污染的特点表现在以下几方面:
1)在天然水中只要有微量重金属即可产生毒性效应,一般重金属产生毒性的范围大约在1—10毫克/升之间,毒性较强的金属如汞、镉等产生毒性的浓度范围在0.01—0.001毫克/升以上;
2)水体中的某些重金属可在微生物作用下转化为毒性更强的金属化合物,如汞的甲基化作用就是这方面的典型例子;
本文标题:水体中主要污染物的来源及影响(11)
手机页面:http://m.dljs.net/dlsk/baogai/10860.html
本文地址:http://www.dljs.net/dlsk/baogai/10860.html

